आवर्त सारणी से संबंधित विभिन्न परीक्षाओं में पूछे गए प्रश्नों का एक रेखिये संग्रह जिसे आगामी परीक्षाओं में पूछे जाने की संभावना है। इसे पढ़कर आप अपनी तैयारी का और भी अधिक सफल बना सकते हैं।
आवर्त सारणी से संबंधित ऑब्जेक्टिव प्रश्न उत्तर पढ़ें।
- 1800 में केवल 30 तत्वों को जाना जाता था। जैसा कि अधिक से अधिक तत्वों की खोज की गई थी, तत्वों और उनके गुणों को याद करना वैज्ञानिकों के लिए बोझ था।
- इसलिए, उन्होंने तत्वों के बारे में जानकारी इकट्ठा करना शुरू किया और इसे वर्गीकृत किया।
- पृथ्वी की पपड़ी में मौजूद कई तत्व 18 वीं शताब्दी तक वैज्ञानिकों द्वारा पृथक किए गए थे। पहले इन तत्वों को मोटे तौर पर धातुओं और गैर-धातुओं के रूप में वर्गीकृत किया गया था।
- हालांकि, जैसे-जैसे वर्ष बीतते गए तत्वों की संख्या बढ़ती गई और यह व्यापक वर्गीकरण सभी तत्वों को समूहीकृत करने का एक कारगर तरीका नहीं था।
- इसलिए, वैज्ञानिकों द्वारा कुछ अवलोकनों के आधार पर तत्वों को समूहीकृत करने के लिए विभिन्न परीक्षण किए गए।
- कुछ लोकप्रिय विधियाँ डोबेरेनर के ट्रायड्स और न्यूलैंड के सप्तक के नियम थे।
- तत्वों को उनके गुणों के अनुसार सारणीबद्ध रूप में वर्गीकृत करना वर्गीकरण का एक लोकप्रिय तरीका था और इसे आवर्त सारणी के रूप में जाना जाता है।
- आवर्त सारणी में 118 तत्व मौजूद हैं, जिनमें से 94 तत्व प्राकृतिक तत्व हैं और 24 तत्व सिंथेटिक तत्व हैं।
- जोहान वोल्फगैंग डोबेरिनर एक जर्मन रसायनज्ञ थे जिन्होंने गुणों के आधार पर समान तत्वों को समूहीकृत करने की कोशिश की।
- उन्होंने कई प्रयोग किए और रुझानों का अवलोकन किया।
- उन्होंने अंततः प्रत्येक त्रय में तत्वों के परमाणु द्रव्यमान के आधार पर 1817 में तीन के समूहों में तत्वों को वर्गीकृत किया।
- प्रत्येक समूह में तीन तत्व होने के कारण इन समूहों को त्रयोदशी कहा जाता था।
- डोबरिनियर के तीनों नियमों के अनुसार: जब परमाणु द्रव्यमान को बढ़ाने के क्रम में तत्वों की व्यवस्था की जाती है, तो तीन तत्वों के समूह जिन्हें त्रिक के रूप में जाना जाता है, में समान रासायनिक गुण होते हैं।
- तो, कानून के अनुसार, त्रय के मध्य तत्व का परमाणु द्रव्यमान अन्य दो तत्वों के परमाणु द्रव्यमान के अंकगणितीय माध्य के बराबर है।
मैंदिलीव का आदर्श टेबल
- दिमित्री इवानोविच मेंडलेव एक रूसी रसायनज्ञ थे। आवर्त सारणी के प्रारंभिक विकास में उन्हें सबसे महत्वपूर्ण योगदानकर्ता माना जाता है ।
- न्यूलैंड्स ऑक्टेव कानून को अस्वीकार कर दिया गया था और 1869 में, मेंडेलीव आवर्त सारणी चित्र में आई। मेंडेलीव आवधिक तालिका कई आवधिक तालिकाओं में सबसे महत्वपूर्ण थी जो बनाई गई थीं।
- मेंडेलीव ने जब प्रयोग किए तो केवल 63 तत्व ज्ञात थे। उन्होंने 63 कार्ड लिए और प्रत्येक कार्ड पर एक तत्व के गुण लिखे।
- उन्होंने तत्वों को समान गुणों के साथ समूहीकृत किया और इसे दीवार पर पिन किया। उन्होंने हर तत्व के गुणों का अध्ययन किया और पाया कि तत्वों के गुण समय-समय पर परमाणु द्रव्यमान से संबंधित थे।
- उन्होंने पाया कि तत्वों को परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया गया था और समान गुणों वाले तत्वों की आवधिक घटना थी।
- इसलिए, उन्होंने ऐसे तत्वों की व्यवस्था की कि समान गुणों वाले तत्व आवधिक तालिका के समान ऊर्ध्वाधर स्तंभों में गिर गए।
- तत्वों की व्यवस्था उनके परमाणु द्रव्यमान और उनके रासायनिक गुणों की समानता के आधार पर होती है।
- इस अवलोकन के आधार पर, मेन्डेलेव ने 1869 में एक आवधिक कानून दिया।
- मेंडेलीव के आवधिक कानून के अनुसार: तत्वों का गुण उनके द्रव्यमान का आवधिक कार्य है। मेंडेलीव की मूल आवर्त सारणी में सात क्षैतिज पंक्तियाँ होती हैं जिन्हें काल कहा जाता है और समूह को आठ ऊर्ध्वाधर स्तंभ कहते हैं। मेंडेलीव को दो कारकों द्वारा निर्देशित किया गया था:
- परमाणु द्रव्यमान बढ़ाना, और समान गुणों वाले तत्वों का एक साथ समूहीकरण करना।
- मेंडेलीव ने रासायनिक गुणों के बीच हाइड्राइड और ऑक्साइड के फार्मूले को श्रेणीकरण के बुनियादी मानदंडों में से एक माना।
मैंदिलीव सामग्री का वर्गीकरण:
- मेंडेलीव के आवधिक कानून ने कुछ तत्वों के अस्तित्व की भविष्यवाणी की थी जो उस समय की खोज नहीं की गई थी। मेंडेलीव की आवर्त सारणी ने उन तत्वों के लिए उचित अंतराल छोड़ दिया जो उस समय नहीं खोजे गए थे, जैसे गैलियम (Ga), स्कैंडियम (Sc) और जर्मेनियम (Ge)
- मेंडेलीव की आवर्त सारणी आवर्त सारणी में उनके पदों के आधार पर कई तत्वों के गुणों की भविष्यवाणी कर सकती है। गैलियम, स्कैंडियम और जर्मेनियम जैसे तत्कालीन अनदेखे तत्वों के गुणों की भविष्यवाणी इस प्रकार की गई थी।
- जब वे खोजे गए तो मेंडेलीव की आवर्त सारणी नेक गैसों को समायोजित कर सकती थी। उन्हें अन्य तत्वों के अस्तित्व क्रम को परेशान किए बिना एक नए समूह में रखा गया था।
मैंदिलीव तत्वों का वर्गीकरण
- समस्थानिक एक समान रासायनिक गुण वाले तत्व हैं लेकिन विभिन्न परमाणु द्रव्यमान हैं। मेंडेलीव ने आइसोटोप की स्थिति के बारे में कोई स्पष्टीकरण नहीं दिया
- कुछ तत्वों के परमाणु द्रव्यमान के गलत क्रम के बारे में कोई उचित स्पष्टीकरण नहीं। उदाहरण के लिए, रासायनिक गुणों के आधार पर तत्वों की व्यवस्था पर; 58.9 के उच्च परमाणु द्रव्यमान वाले कोबाल्ट का तत्व पहले और निकल तत्व का होता है, जिसमें 58.7 का थोड़ा कम परमाणु द्रव्यमान होता है। मेंडेलीव के आवधिक कानून परमाणु जनता के गलत होने की इस असामान्य स्थिति की व्याख्या नहीं कर सके।
- आवर्त सारणी पर हाइड्रोजन को कोई नियत स्थान नहीं दिया गया था।
लंबवत टेबल का इतिहास
- वैज्ञानिकों ने माना कि तत्वों के गुण उनके परमाणु द्रव्यमानों के आवधिक कार्य हैं और इस धारणा के आधार पर, मेंडेलीव ने 63 तत्वों को एक ऊर्ध्वाधर स्तंभ में रखा, जिन्हें समूह कहा जाता है और क्षैतिज पंक्तियों में कहा जाता है।
- हालांकि, वर्गीकरण का यह तरीका कुछ तत्वों, दुर्लभ पृथ्वी धातुओं और समस्थानिकों की स्थिति की व्याख्या नहीं कर सका। इसलिए, इसे अस्वीकार कर दिया गया था।
- इसलिए, हेनरी मोस्ले ने वर्ष 1923 में, "परमाणु संख्या" तत्वों की एक नई संपत्ति दी। उन्होंने माना कि किसी तत्व की परमाणु संख्या परमाणु द्रव्यमान से अधिक मौलिक गुण है।
आधुनिक आवर्त नियम
- आधुनिक आवधिक कानून के अनुसार: तत्वों के गुण उनके परमाणु संख्याओं का आवधिक कार्य होते हैं ।
- जब तत्वों को बढ़ती हुई परमाणु संख्या के अनुसार व्यवस्थित किया जाता है, तो समान वैलेंस इलेक्ट्रॉनों वाले तत्व नियमित अंतराल पर होते हैं।
आधुनिक लंबवत टेबल या लंबवत टेबल के लम्ब रूप
- आधुनिक (दीर्घ रूप) आवधिक तालिका में तत्वों की व्यवस्था उनके इलेक्ट्रॉनिक कॉन्फ़िगरेशन पर आधारित है ।
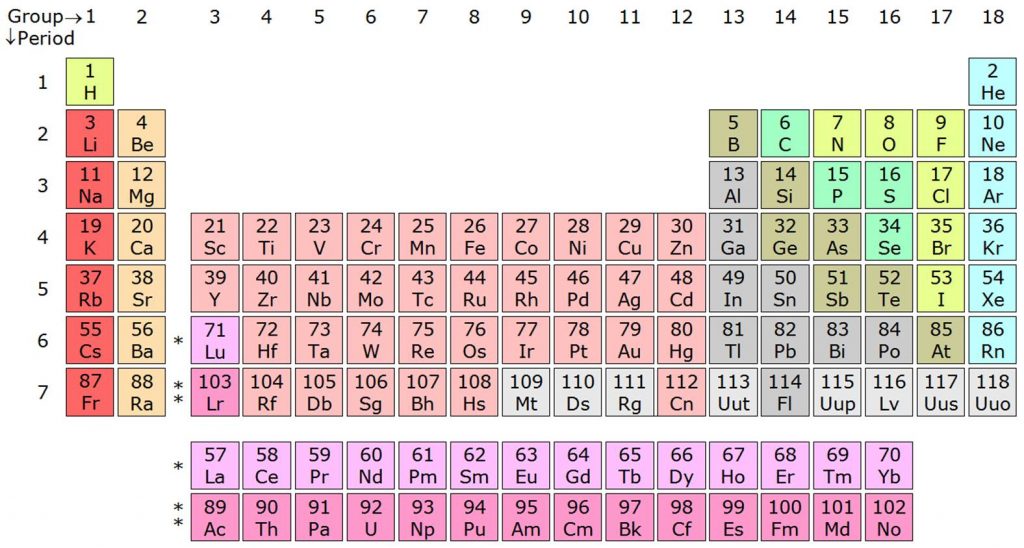
आधुनिक आदर्श की विशेषताएं
- आधुनिक आवर्त सारणी में 18 समूह और 7 अवधियाँ हैं।
- अवधि: आवधिक तालिका में तत्वों की क्षैतिज पंक्तियों को अवधि कहा जाता है । आवर्त सारणी के लंबे रूप में सात काल हैं।
- पहली अवधि - 2 तत्व- बहुत कम अवधि
- दूसरा काल- 8 तत्व- लघु अवधि
- तीसरी अवधि -8 तत्व- लघु अवधि
- चौथी अवधि- 18 तत्व- लंबी अवधि
- पांचवीं अवधि- 18 तत्व- लंबी अवधि
- छठी अवधि- 32 तत्व- बहुत लंबी अवधि
- सातवीं अवधि- 32 तत्व- बहुत लंबी अवधि
- एक अवधि में तत्वों की संख्या इलेक्ट्रॉनों की अधिकतम संख्या से तय होती है जिसे एक परमाणु के विभिन्न गोले में समायोजित किया जा सकता है।
- समूह: एक आवर्त सारणी में लंबवत स्तंभों को समूह कहा जाता है । आवर्त सारणी के लंबे रूप में 18 समूह हैं।
- एक समूह के सभी तत्वों में समान इलेक्ट्रॉनिक कॉन्फ़िगरेशन है और समान गुण दिखाते हैं।
धातुओं, गैर-धातुओं के निर्माण:
- तालिका के दाईं ओर विकर्ण रेखा दो तत्वों को अलग करती है: धातु और अधातु।
- इस रेखा के बाईं ओर जो तत्व होते हैं, वे धातु के होते हैं, जबकि दाईं ओर वे अधातु होते हैं।
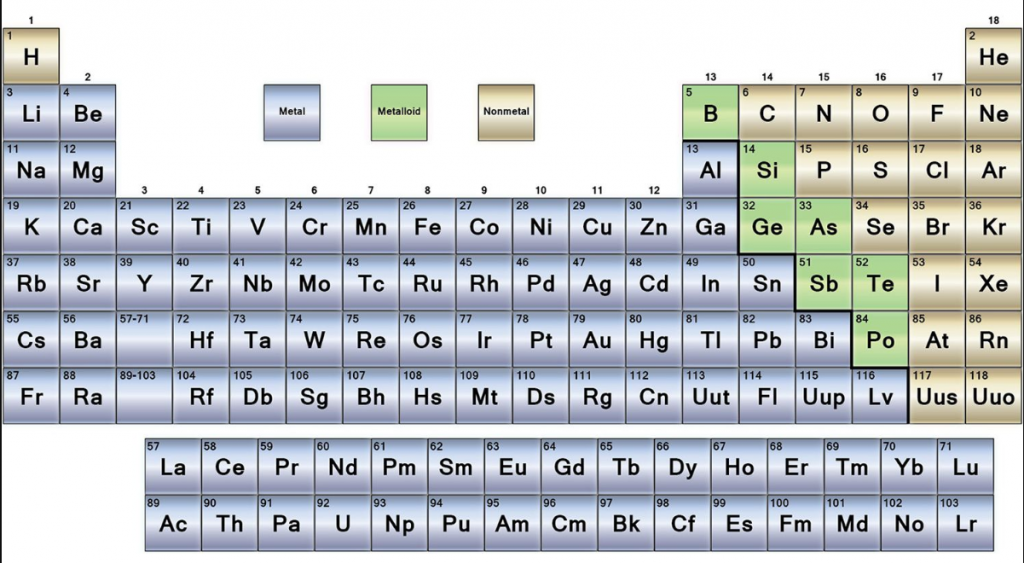
- यहाँ, धातुओं को धातु से कुछ तत्वों द्वारा अलग किया गया है जिन्हें 'मेटलॉयड' कहा जाता है जिन्हें आवर्त सारणी में तिरछे रखा गया है।
- ये मेटलॉयड हैं: बोरॉन (बी); सिलिकॉन (एस); जर्मेनियम (जीई); आर्सेनिक (अस); सुरमा (Sb)।
- तत्वों के भौतिक और रासायनिक गुण आवर्त सारणी के ओरीओड और समूहों में एक नियमित रूप से भिन्नता दर्शाते हैं।
- एक तत्व के गुण आधुनिक आवर्त सारणी के अनुसार उनके परमाणु संख्या का आवधिक कार्य हैं, तत्वों के इलेक्ट्रॉनिक विन्यास से संबंधित हैं।
- गुणों में एक सामान्य प्रवृत्ति है क्योंकि एक अवधि में बाएं से दाएं या समूह के नीचे से एक चलता है।
- गुणों में इस प्रवृत्ति को आवधिक गुणों के रूप में जाना जाता है, जिनमें से सबसे महत्वपूर्ण हैं परमाणु आकार, धातु चरित्र, गैर-धातु चरित्र, आयनीकरण क्षमता, इलेक्ट्रॉन आत्मीयता , और इलेक्ट्रोनगेटिविटी।
अवधि
- प्रत्येक छोटी अवधि में बाएं से दाएं जाने पर, तत्वों की वैधता 1 से 4 तक बढ़ जाती है और फिर घटकर शून्य हो जाती है।
- एक ही अवधि में तत्वों की अलग-अलग वैधता होती है।
- एक तत्व की वैधता तत्व के परमाणु में मौजूद वैलेंस इलेक्ट्रॉनों की संख्या से निर्धारित होती है।
- निकटतम अक्रिय गैस विन्यास को प्राप्त करने के लिए किसी तत्व के एक परमाणु द्वारा खोए या प्राप्त किए गए इलेक्ट्रॉनों की संख्या, तत्व की वैधता देती है।
परमाणु आकार
- परमाणु त्रिज्या नाभिक के केंद्र और एक परमाणु के सबसे बाहरी खोल के बीच की दूरी है।
- एक समूह में एक अवधि से दूसरी अवधि के रूप में गोले के जोड़ के कारण परमाणु आकार बढ़ता है।
- परमाणु का आकार एक अवधि के दौरान कम हो जाता है क्योंकि शेल की संख्या समान रहती है लेकिन परमाणु चार्ज बढ़ता है।
- तो, इलेक्ट्रॉनों को सबसे बाहरी खोल से नाभिक की ओर खींचा जाता है और उनका आकार कम हो जाता है।
- धातुएं ऐसे तत्व हैं जो इलेक्ट्रॉनों को खो देते हैं जो कि पिंजरे बनाते हैं।
- जैसे-जैसे हम समूह को आगे बढ़ाते हैं, धात्विक चरित्र बढ़ता जाता है।
- ऐसा इसलिए है क्योंकि परमाणु का आकार इतना बढ़ जाता है कि इलेक्ट्रॉन आसानी से खो जाते हैं।
- परमाणु आकार एक अवधि में घटता है जब हम बाएं से दाएं चलते हैं क्योंकि परमाणु प्रभार में वृद्धि होती है।
- इसलिए इलेक्ट्रॉनों को खोना एक परमाणु के लिए मुश्किल है।
- गैर-धातु ऐसे तत्व हैं जिनकी इलेक्ट्रॉनों को प्राप्त करने की प्रवृत्ति होती है।
- एक अवधि में एक कदम के रूप में गैर-धातु चरित्र बढ़ता है।
- यह परमाणु चार्ज में वृद्धि और परमाणु आकार में कमी के कारण है।
- लेकिन जैसे-जैसे हम समूह को नीचे ले जाते हैं परमाणु आकार में वृद्धि के कारण गैर-धातु वर्ण घटता जाता है।
- रासायनिक प्रतिक्रिया:
- किसी अवधि में बाएं से दाएं जाने पर, तत्वों की रासायनिक प्रतिक्रिया पहले घट जाती है और फिर बढ़ जाती है।
- एक समूह के सभी तत्व समान रासायनिक गुणों को दर्शाते हैं।
- आवधिक तालिका के समूह में नीचे जाने पर धातुओं की रासायनिक प्रतिक्रिया बढ़ जाती है।
- आवधिक तालिका के समूह में नीचे जाने पर गैर-धातुओं की रासायनिक प्रतिक्रिया कम हो जाती है।
- एक अवधि में बाएं से दाएं जाने पर, आक्साइड की मूल प्रकृति घट जाती है और आक्साइड की अम्लीय प्रकृति बढ़ जाती है।
- आवर्त सारणी के एक समूह में नीचे जाने पर, तत्व के आक्साइड की प्रकृति में कोई परिवर्तन नहीं होता है।
परफॉरमेंस की वर्णव्यवस्था
- एक अवधि में बाएं से दाएं जाने पर, तत्वों में वैलेंस इलेक्ट्रॉनों की संख्या 1 से 8 तक बढ़ जाती है।
- संयोजकता
- प्रत्येक छोटी अवधि में बाएं से दाएं जाने पर, तत्वों की वैधता 1 से 4 तक बढ़ जाती है। फिर घटकर 0 (शून्य) हो जाती है।
- परमाणुओं का आकार (या परमाणु आकार)
- किसी अवधि में बाएं से दाएं जाने पर परमाणुओं का आकार (परमाणु आकार) घट जाता है।
- किसी अवधि में बाएं से दाएं जाने पर, तत्वों का धातु वर्ण कम हो जाता है, जबकि गैर-धातु का चरित्र बढ़ जाता है।
- रासायनिक प्रतिक्रिया
- किसी अवधि में बाएं से दाएं जाने पर, तत्वों की रासायनिक प्रतिक्रिया पहले घट जाती है और फिर बढ़ जाती है।
- ग्रूप के वर्णक्रम:
- आवर्त सारणी के एक समूह के सभी तत्वों में वैलेंस इलेक्ट्रॉनों की समान संख्या होती है।
- उदाहरण के लिए, समूह I के तत्व: ली, ना, के आदि, सभी की वैधता है। समूह 17 के तत्व: Cl, Br, I आदि, सभी की वैधता है।
टिप्पणियाँ